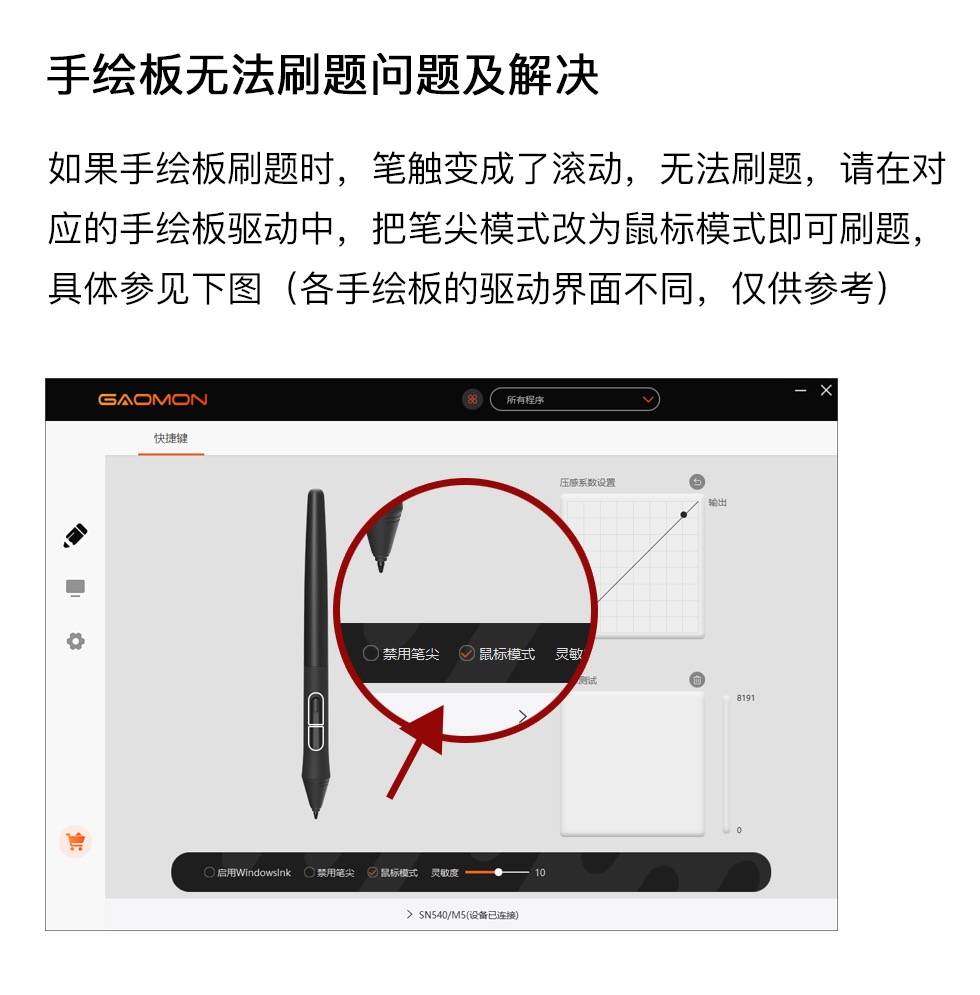
甲 | 乙 | 丙 | 丁 | |
A | Na2CO3 | H2SO4 | Ba(OH)2 | 石蕊 |
B | Na2CO3 | HCl | Ca(OH)2 | CuSO4 |
C | Na2SO4 | HCl | Ba(OH)2 | 石蕊 |
D | HCl | Na2CO3 | Ca(OH)2 | 酚酞 |


选项 | 物质 | 杂质 | 所用试剂及操作方法 |
A | NaCl | NaOH | 加入过量的稀盐酸,过滤,蒸发结晶 |
B | CO2 | HCl | 通过盛有足量NaOH溶液的洗气瓶, 再通过盛有浓硫酸的洗气瓶 |
C | NaOH溶液 | Ca(OH)2 | 加过量的Na2CO3溶液,过滤 |
D | CuSO4溶液 | H2SO4 | 过量的CuO,过滤 |

















 石灰石做华表
石灰石做华表  氢氧化钠改良土壤
氢氧化钠改良土壤 熟石灰做干燥剂
熟石灰做干燥剂  碳酸钠制洗涤剂
碳酸钠制洗涤剂




 2MgO
2MgO Cu+Cl2↑
Cu+Cl2↑

A________; B________; C________; D________。

A.维生素 B.氧气(或空气) C.尿素[CO(NH2)2]
D.一氧化碳(CO) E.氮气(N2) F.小苏打(NaHCO3)

a.聚乙烯塑料 b.不锈钢 c.有机玻璃 d.金属铜 e.玻璃钢 f.四氧化三铁 g.涤纶
①选出的一组物质为_________ (填字母);②分类依据是_________。

①冰水共存物 ②液氧 ③空气 ④纯碱 ⑤硫酸 ⑥火碱 ⑦过氧化氢 ⑧高锰酸钾

①请完成下表
序 列 | 物质分类的角度 | 实例 | 化学方程式 | |
反应物 | 生成物 | |||
1 | 盐和碱 | 盐和碱 | 碳酸钠和氢氧化钡 | Na2CO3+Ba(OH)2→BaCO3↓+2NaOH |
2 | 酸和金属 | 盐和氢气 | 铁和稀硫酸 | ________ |
3 | 盐和盐 | 盐和盐 | 硝酸银和________ | ________ |
4 | 盐和金属 | 盐和金属 | 锌和硫酸铜溶液 | ________ |
②表中属于复分解反应的有________个;“锌和硫酸铜溶液”反应中现象是________。
③可见,生成盐的途径有多种。当生成物中有硫酸钠时,可以是硫酸和氢氧化钠的反应,也可以是________和________(写出具体物质的名称或化学式,酸和碱反应除外)。
④除了表中所列,盐还能与________(填物质类别名称)反应。

某工业园区甲、乙两化工厂排放的废水中含有K+、Cu2+、Fe3+、Cl- 、OH-、NO3-六种离子,甲厂含有其中的三种,乙厂含有另外三种,两厂废水的直接排放对当地水质带来严重影响。某课外实践小组对两厂废水进行实地检测,发现甲厂废水呈碱性。

加入的试剂 | 现象 | 结论 | |
方案1 | 二氧化碳 | A中出现白色浑浊,B中无明显现象。 | A是_________溶液, B是另一种溶液。 |
方案2 | 碳酸钠溶液 | _________。 | |
方案3 | 试剂X | …… |
写出方案1中发生反应的化学方程式_________。
【拓展应用】完成方案3,请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X:_________。(填序号)
①酚酞溶液 ②pH试纸 ③镁 ④氧化铜
⑤稀硝酸 ⑥氢氧化铜 ⑦氯化镁溶液 ⑧硝酸钡溶液

溶液C和溶液D混合,可能会出现以下三种情况:
①有沉淀产生时,写出其中发生反应的化学方程式_________。
②有气泡冒出时,可通过现象反推出溶液C中的溶质是_________。
③无明显现象时,混合物E中一定含有的溶质是_________;混合物E中所含溶质种类最多时,写出所有溶质的化学式_________。




反应①;
反应③;
反应⑥。


请回答下列问题:
由此得出该溶液中溶质成分为NaCl和Na2CO3。如果用该溶液蒸发结晶,则得不到更纯的NaCl。


【提出问题】这瓶无色溶液是什么物质的溶液?
【猜想与假设】小组同学提出了如下假设:
①碳酸钠溶液;②硫酸钠溶液;③氯化钠溶液
【讨论交流】在老师的指导下,小组同学经过讨论,认为有一条假设不合理。
【进行实验】小组同学设计并进行了如下实验,请你完善小组同学的“相互评价”。
组次 | 实验操作 | 出现的现象与结论 | 同学相互评价 |
第 1 组 |
| 产生白色沉淀,第 1 组同学认为猜想②成立 | 第 2 组同学认为此方案结论错误。 你认为其理由是硫酸钡和_________都不溶于水。 |
第 2 组 |
| 试管中无明显现象,第2 组同学认为猜想 ②成立。 | 第3组同学认为此方案结论错误。 你认为其理由是_________。 |
第 3 组 |
| 溶液无明显变化,第 3 组同学认为猜想②成立。 | 第 1 组同学认为此方案结论正确。 你认为实验中用点滴板比试管具有更多的优点是_________ (写 1 条即可)。 |
你认为倾倒液体药品时,要注意标签_________。