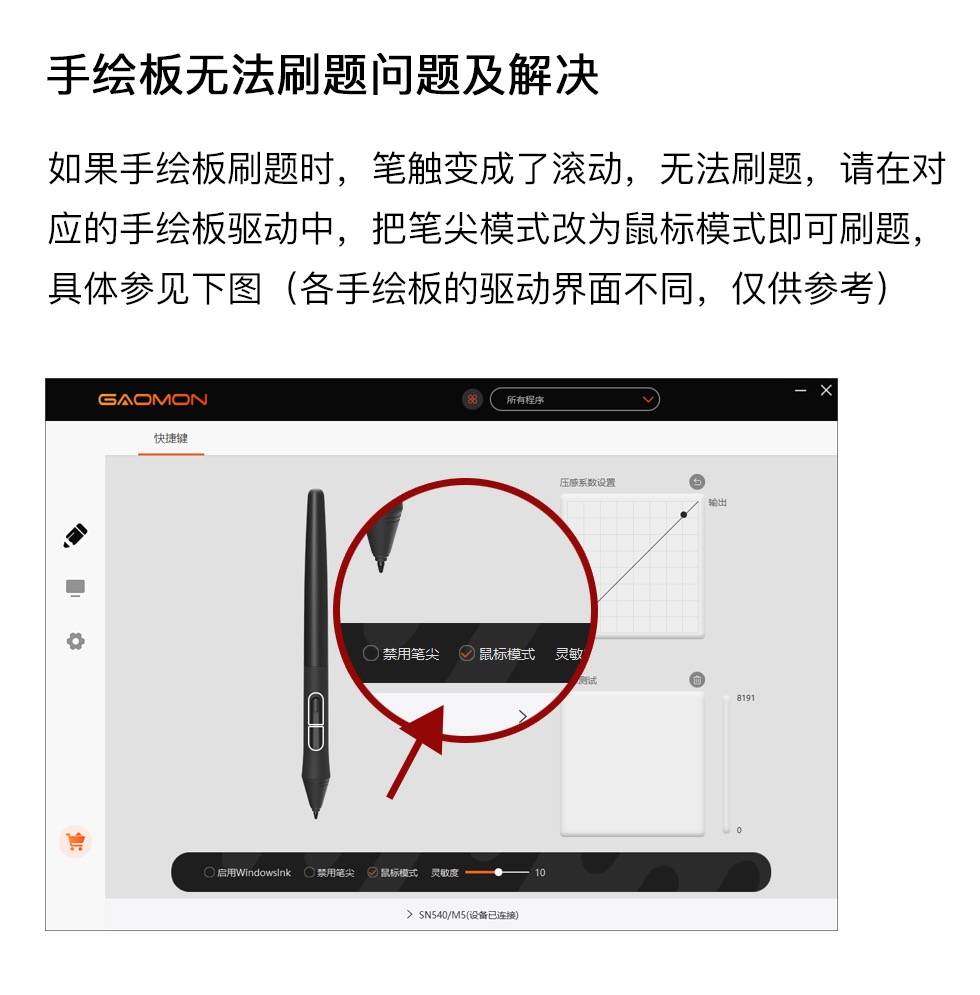
高中化学人教版选修三 课时训练13分子晶体
一、分子晶体的概念和结构特点
医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低 ②HgCl2熔融状态下不导电 ③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.
HgCl2晶体属于分子晶体
B.
HgCl2属于离子化合物
C.
HgCl2属于电解质,且属于强电解质
D.
HgCl2属于非电解质

我要多选
作答:
答对了
答错了
乙醇晶体中不存在的作用力是( )
A.
极性键
B.
非极性键
C.
离子键
D.
氢键

我要多选
作答:
答对了
答错了
下列关于晶体的说法中正确的是( )
A.
分子晶体内一定存在共价键
B.
分子晶体中分子间作用力越大,分子越稳定
C.
冰融化时水分子中的共价键没有断裂
D.
由金属元素和非金属元素形成的化合物一定是离子化合物,其晶体一定不是分子晶体

我要多选
作答:
答对了
答错了
下列各组物质,均属于化合物且均形成分子晶体的是( )
A.
NH3、HD、C10H8
B.
PCl3、CO2、H2SO4
C.
SO2、NaCl、P2O5
D.
CCl4、P4、H2O2

我要多选
作答:
答对了
答错了
下列物质属于分子晶体的化合物是( )
A.
钠
B.
硫黄
C.
干冰
D.
食盐

我要多选
作答:
答对了
答错了
二、分子晶体的性质
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1 000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下列问题。
1、
下列关于天然气水合物中两种分子极性的描述正确的是 。
A.
两种都是极性分子
B.
两种都是非极性分子
C.
CH4是极性分子,H2O是非极性分子
D.
H2O是极性分子,CH4是非极性分子
2、
若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为 。
A.
CH4·14H2O
B.
CH4·8H2O
C.
CH4·  H2O
H2O
 H2O
H2OD.
CH4·6H2O

我要多选
作答:
答对了
答错了
科学家发现的C60是一种新的分子,它具有空心、类似于足球的结构。最近科学家又确认存在着另一种分子“N60”,它与C60的结构相似,在高温或机械撞击时,其积蓄的巨大能量会在一瞬间释放出来。下列关于N60的说法中不正确的是( )
A.
N60是由共价键结合而成的空心球状结构
B.
N60和14N都是氮的同位素
C.
N60的熔、沸点不高
D.
N60可能成为很好的火箭燃料

我要多选
作答:
答对了
答错了
分子晶体一般具有的性质是( )
A.
易溶于水
B.
熔、沸点较高
C.
通常状况下有些是固体,有些是气体,也有的是液体
D.
硬度一般较大

我要多选
作答:
答对了
答错了
短周期元素X、Y、Z在周期表中位置关系如图:

1、
X元素组成的单质的分子式是_________,若X元素的原子核内中子数和质子数相等,则X元素组成的单质的摩尔质量为_________,是_________晶体。
2、
Y元素的名称是_________,其氢化物的沸点_________(填“高于”“低于”或“无法确定”)氯化氢。
3、
Z元素组成的单质的晶体类型属于_________,Z的氢化物和氧化物反应的化学方程式为_________。

我要多选
作答:
答对了
答错了
下列分子晶体在熔化时,只破坏范德华力的是________(填序号,下同),既破坏范德华力,又破坏氢键的是________。
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2
⑥H2O2 ⑦HF ⑧H2N—CH2CH2COOH
⑨C2H6

我要多选
作答:
答对了
答错了
三、达标训练
HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子有几个( )
A.
3
B.
4
C.
5
D.
12

我要多选
作答:
答对了
答错了
下列物质的性质与氢键无关的是( )
A.
冰的密度比液态水的密度小
B.
酒精易溶解在水里
C.
NH3分子比PH3分子稳定
D.
相同条件下,H2O的沸点比H2S的高

我要多选
作答:
答对了
答错了
下列说法正确的是( )
A.
冰融化时,分子中H—O键发生断裂
B.
分子晶体中,分子间作用力越大,通常熔点越高
C.
分子晶体中,共价键键能越大,分子的熔、沸点越高
D.
分子晶体中,分子间作用力越大,分子越稳定

我要多选
作答:
答对了
答错了
某化学兴趣小组,在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl | MgCl2 | AlCl3 | SiCl4 | CaCl2 | |
熔点/℃ | 801 | 712 | 190 | -68 | 782 |
沸点/℃ | 1 465 | 1 418 | 230 | 57 | 1 600 |
根据这些数据分析,他们认为属于分子晶体的是 ( )
A.
NaCl、MgCl2、CaCl2
B.
AlCl3、SiCl4
C.
NaCl、CaCl2
D.
NaCl、MgCl2、AlCl3、SiCl4、CaCl2

我要多选
作答:
答对了
答错了
最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示碳原子,黑点表示钛原子,则它的化学式为 ( )

A.
TiC
B.
Ti13C14
C.
Ti4C7
D.
Ti14C13

我要多选
作答:
答对了
答错了
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
1、
组成A分子的原子的元素符号是_________。
2、
从B分子的立体结构判断,该分子属于_________(填“极性”或“非极性”)分子。
3、
C分子中包含_________个σ键,_________个π键。
4、
D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质): _________。
5、
Ⅱ.CO的结构可表示为  ,N2的结构可表示为
,N2的结构可表示为  。
。
下表是两者的键能数据:(单位:kJ·mol-1)
A—B |
|
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。
6、
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
基态Ni原子的核外电子排布式为_________,基态Cu原子的外围电子排布式为_________。
7、
Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于_________(填晶体类型)。

我要多选
作答:
答对了
答错了
1、
IBr是一种卤素互化物,具有很高的化学活性,有许多性质与卤素相似,它在常温下是深红色液体,熔点为41℃,沸点为116 ℃,固体溴化碘是_________晶体,含有_________键,IBr与水反应生成一种无氧酸和一种含氧酸,反应的化学方程式为_________。
2、
已知AlCl3的熔点为190 ℃(2.202×105 Pa下),但它在180 ℃即开始升华。请回答:
①AlCl3固体是_________晶体;
②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是_________。

我要多选
作答:
答对了
答错了
SiCl4的分子结构与CCl4类似,对其作出如下推断,其中正确的是( )
①SiCl4晶体是分子晶体 ②常温、常压下,SiCl4是液体 ③SiCl4分子是由极性键形成的非极性分子 ④SiCl4的熔点高于CCl4的
A.
①
B.
①②
C.
②③
D.
①②③④

我要多选
作答:
答对了
答错了
下列晶体由原子直接构成,且属于分子晶体的是 ( )
A.
固态氢
B.
固态氖
C.
磷
D.
三氧化硫

我要多选
作答:
答对了
答错了
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )
A.
X、M两种元素只能形成X2M型化合物
B.
由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.
元素Z、W的单质晶体属于不同种类型的晶体
D.
元素W和M的某些单质可作为水处理中的消毒剂

我要多选
作答:
答对了
答错了
声明:本文档由用户提供并上传,仅供用户内部交流学习使用,若内容存在侵权,请点击举报删除。
贡献者:
 小白兔呀。
小白兔呀。