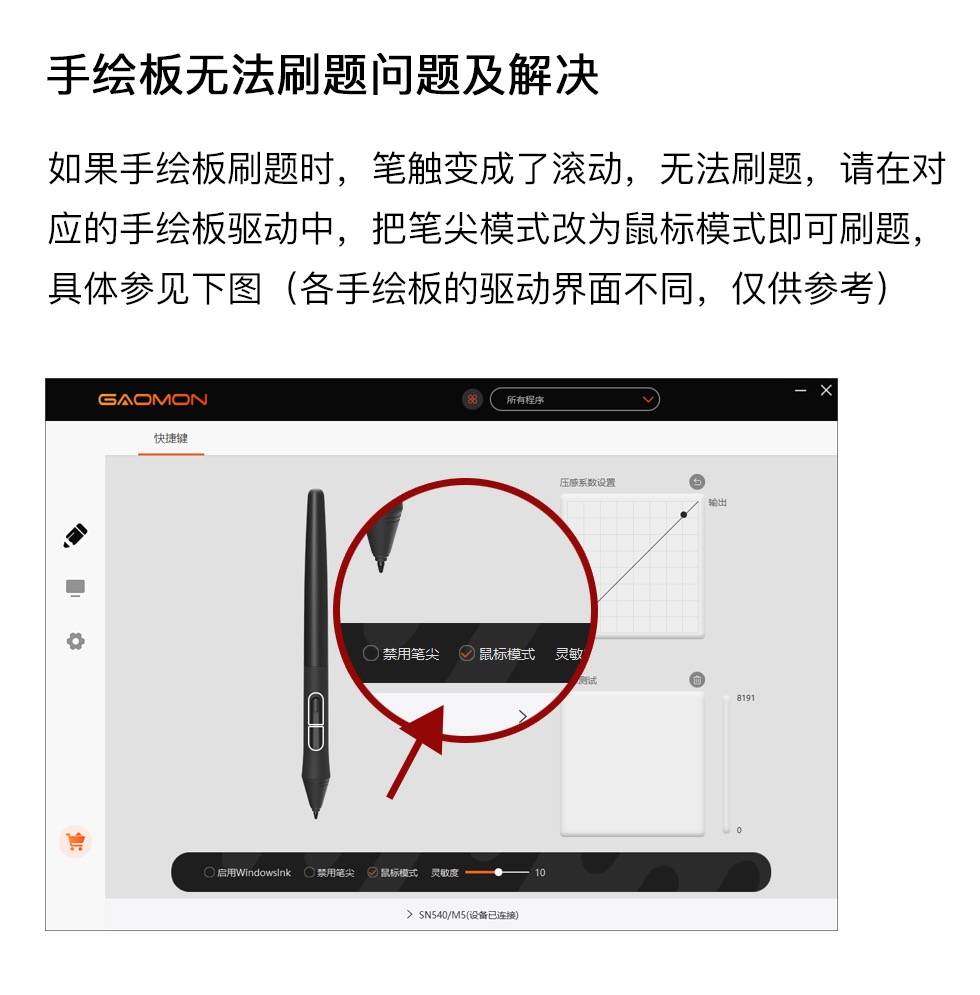
沪科版(新教材)化学选择性必修2第1章 原子结构与性质1.2 多电子原子核外电子的排布同步测试
一、选择题
下列有关原子结构的说法正确的是
A.
霓虹灯发光与原子核外电子跃迁释放能量有关
B.
氖原子与钠离子两粒子的2p能级上的电子离核的距离相同
C.
M能层中有3s、3p、3d、3f四个能级,共16个轨道
D.
基态镁原子核外电子的轨道表示式为


我要多选
作答:
答对了
答错了
下列说法正确的是
A.
2p、3p、4p能级的轨道数依次增多
B.
第四周期元素中未成对电子数最多的元素原子序数为23
C.
同一周期中,随着核电荷数的增加,元素的第一电离能逐渐增大
D.
元素周期表中从第IIIB族到第IIB族10个纵列的元素均为金属元素

我要多选
作答:
答对了
答错了
下列各组表述中,两个原子不属于同种元素原子的是
A.
3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.
2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.
M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.
最外层电子数是核外电子总数 的原子和最外层电子排布式为4s24p5的原子
的原子和最外层电子排布式为4s24p5的原子
 的原子和最外层电子排布式为4s24p5的原子
的原子和最外层电子排布式为4s24p5的原子
我要多选
作答:
答对了
答错了
某元素简化电子排布式为[Xe]4f106s2,其应在
A.
s区
B.
p区
C.
d区
D.
f区

我要多选
作答:
答对了
答错了
在日常生活中,许多的可见光都与原子核外电子跃迁有关,下列情境与此无关的是
A.
节日燃放的焰火
B.
蓝色的钴玻璃
C.
各色的LED灯
D.
太阳耀眼的光

我要多选
作答:
答对了
答错了
氯仿保存不当会产生光气:2CHCl3+O2 → 2HCl+2COCl2,下列相关化学用语正确的是
A.
CHCl3的球棍模型:

B.
O原子的轨道表示式:

C.
氯离子的结构示意图:

D.
光气的电子式:


我要多选
作答:
答对了
答错了
某基态原子的所有含电子的能层中,其最高能层所含电子最少,且基态原子核外有15种不同空间运动状态的电子,则该原子的元素符号可能是
A.
K
B.
Sc
C.
Cu
D.
Ga

我要多选
作答:
答对了
答错了
下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是
A.
Cu位于元素周期表中第四周期第IB族,属于ds区元素
B.
O的基态原子中,2p能级为半充满,属于p区元素
C.
最外层电子排布式为4s1,一定属于第IA族
D.
最外层电子排布式为ns2np1,该元素可能是第IIIA族或第IIIB族

我要多选
作答:
答对了
答错了
硼酸和乙醇可以发生酯化反应:B(OH)3+3C2H5OH (C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是
(C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是
 (C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是
(C2H5O)3B+3H2O。生成的硼酸三乙酯点燃时产生绿色火焰,可通过该现象鉴定硼酸,下列表示正确的是A.
中子数为8的O原子:

B.
乙醇分子的比例模型:

C.
基态C原子核外价电子的轨道表达式:

D.
硼酸在水中的电离方程式:B(OH)3+H2O=B(OH) +H+
+H+
 +H+
+H+
我要多选
作答:
答对了
答错了
下列含氮微粒的化学用语表达正确的是
A.
氮-14原子:

B.
氮原子的轨道表示式:

C.
氨气的电子式:

D.
氮气的结构式:N≡N

我要多选
作答:
答对了
答错了
二、填空题
Ⅰ.已知某原子的电子排布式:1s22s22p63s23p63d104s24p3
(1)该元素的原子序数是_______。
(2)该元素属第_______周期第_______族。
(3)该元素的价电子排布式是_______。
Ⅱ.回答下列问题
(4)写出Cr核外电子排布式_______,位于元素周期表的_______区。
(5)Fe2+与Fe3+未成对电子数之比为_______(用a:b的形式表示)。
(1)该元素的原子序数是_______。
(2)该元素属第_______周期第_______族。
(3)该元素的价电子排布式是_______。
Ⅱ.回答下列问题
(4)写出Cr核外电子排布式_______,位于元素周期表的_______区。
(5)Fe2+与Fe3+未成对电子数之比为_______(用a:b的形式表示)。

我要多选
作答:
答对了
答错了
按要求书写下列基态原子或离子的电子排布式。
(1)Na:____ 。
(2)F-:____ 。
(3)Fe3+的简化电子排布式:____ 。
(1)Na:
(2)F-:
(3)Fe3+的简化电子排布式:

我要多选
作答:
答对了
答错了
A、B、C、D、E代表5种元素,请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该原子的电子排布式为_______ 。
(2)B元素的负一价离子和C元素的正一价离子的电子排布式都与氩原子相同,B元素的符号为_______ ,C的离子结构示意图为_______ 。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为_______ ,其基态原子的价电子排布式为_______ 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为_______ ,其基态原子的价电子排布图为_______ 。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该原子的电子排布式为
(2)B元素的负一价离子和C元素的正一价离子的电子排布式都与氩原子相同,B元素的符号为
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为

我要多选
作答:
答对了
答错了
氮、氧、氯是短周期中典型的非金属元素。
(1)氮原子核外共有_______ 种能量不同的电子,氯原子能量最高的电子有_______ 种电子云伸展方向。
(2)亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到8e结构,则其电子式为_______ 。
已知:① 具有毒性和强氧化性。②酸性
具有毒性和强氧化性。②酸性 。
。
(3)含 的废水直接排放会引起严重的水体污染,通常采用还原法将其转化为对环境无污染的气体排放,如工业上采用KI或
的废水直接排放会引起严重的水体污染,通常采用还原法将其转化为对环境无污染的气体排放,如工业上采用KI或 处理,请写出
处理,请写出 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
(4)往冷 溶液中加入下列某种物质可得
溶液中加入下列某种物质可得 稀溶液。该物质是
稀溶液。该物质是_______ (填序号)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(5) 有咸味,不法商家会用其制作假食盐,引发中毒事故。请写出一种简单的方法检验NaCl中是否含有
有咸味,不法商家会用其制作假食盐,引发中毒事故。请写出一种简单的方法检验NaCl中是否含有 :
:_______ 。
(1)氮原子核外共有
(2)亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到8e结构,则其电子式为
已知:①
 具有毒性和强氧化性。②酸性
具有毒性和强氧化性。②酸性 。
。(3)含
 的废水直接排放会引起严重的水体污染,通常采用还原法将其转化为对环境无污染的气体排放,如工业上采用KI或
的废水直接排放会引起严重的水体污染,通常采用还原法将其转化为对环境无污染的气体排放,如工业上采用KI或 处理,请写出
处理,请写出 与
与 反应的离子方程式:
反应的离子方程式:(4)往冷
 溶液中加入下列某种物质可得
溶液中加入下列某种物质可得 稀溶液。该物质是
稀溶液。该物质是a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(5)
 有咸味,不法商家会用其制作假食盐,引发中毒事故。请写出一种简单的方法检验NaCl中是否含有
有咸味,不法商家会用其制作假食盐,引发中毒事故。请写出一种简单的方法检验NaCl中是否含有 :
:
我要多选
作答:
答对了
答错了
完成下表
| 核素 | 核电荷数 | 中子数 | 电子排布 | 元素所在周期 | 元素所在族 |
 | 3 | ||||
 | 2 | VI A族 | |||
 | 2,8,8 |

我要多选
作答:
答对了
答错了
现有4种元素,其中A、B、C为短周期主族元素,D为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了___________ 。
(2)D基态原子中能量最高的电子,其电子云在空间有___________ 个方向。
(3)B的电子排布式___________ ,C的外围电子轨道表示式___________ ,D3+的外围电子排布式___________
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外电子排布为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(2)D基态原子中能量最高的电子,其电子云在空间有
(3)B的电子排布式

我要多选
作答:
答对了
答错了
三、综合题
周期表中前20种元素X、Y、Z、W原子序数依次增大,它们的结构性质等信息如下表所述:
请根据信息回答有关问题:
(1)元素X的原子核外共有_______ 种不同运动状态的电子,其基态原子中最高能级的电子云轮廓图形状是_______ 。
(2)Y的核外电子轨道表示式是_______ ,其价层电子的电子云在空间有_______ 种伸展方向。
(3)由X原子构成的共价晶体的名称是_______ ,晶体中X原子的杂化形式是_______ 。
(4)由Z和Y形成YZ3分子的电子式为_______ ,是_______ (填“极性”或“非极性”)分子。
| 元素 | 结构性质等信息 |
| X | 基态原子有三个能级,每个能级上的电子数都相等 |
| Y | 该元素原子价层电子排布式为nsnnpn+1 |
| Z | 常温常压下,该元素构成的单质是一种有毒的黄绿色气体 |
请根据信息回答有关问题:
(1)元素X的原子核外共有
(2)Y的核外电子轨道表示式是
(3)由X原子构成的共价晶体的名称是
(4)由Z和Y形成YZ3分子的电子式为

我要多选
作答:
答对了
答错了
钒具有广泛用途,利用含钒废催化剂(主要含有V2O5、VOSO4和不溶性硅酸盐)制备V2O5的新工艺流程如图:

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式_______ 。
(2)在实验室中操作Ⅰ用到的玻璃仪器有_______ 。
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为_______ 。
(4)混合溶液中加入KClO3,发生反应的离子方程式是_______ 。
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是_______ (写一条即可)。

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为_______ (写出计算过程)[已知(VO2)2SO4和(NH4)2Fe(SO4)2溶液反应的离子方程式为VO +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式
(2)在实验室中操作Ⅰ用到的玻璃仪器有
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为
(4)混合溶液中加入KClO3,发生反应的离子方程式是
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入
 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为 +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]
我要多选
作答:
答对了
答错了
氮元素和氯元素在自然界广泛存在,请回答下列问题
(1)氮元素原子核外有_______ 个未成对电子,有_______ 种能量不同的电子,能量最高的电子的电子云有_______ 种伸展方向。氯元素原子最外层电子排布式为_______ 。
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是_______(填编号)。(3)已知,氯胺(NH2Cl)熔点-66℃,NH4Cl熔点340℃,氯胺中所有原子最外层均满足饱和结构,则其电子式为_______ ;从物质结构的角度解释两者熔点相差较大的原因_______ 。
(4)NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为_______ 。
(1)氮元素原子核外有
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是_______(填编号)。(3)已知,氯胺(NH2Cl)熔点-66℃,NH4Cl熔点340℃,氯胺中所有原子最外层均满足饱和结构,则其电子式为
(4)NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为
A.
NH3比PH3稳定性强
B.
氮气性质很稳定,而磷较活泼,可在空气中燃烧。
C.
硝酸显强氧化性,磷酸不显强氧化性
D.
氮气常温是气体,磷单质是固体

我要多选
作答:
答对了
答错了
声明:本文档由用户提供并上传,仅供用户内部交流学习使用,若内容存在侵权,请点击举报删除。
贡献者:
 旎裳
旎裳