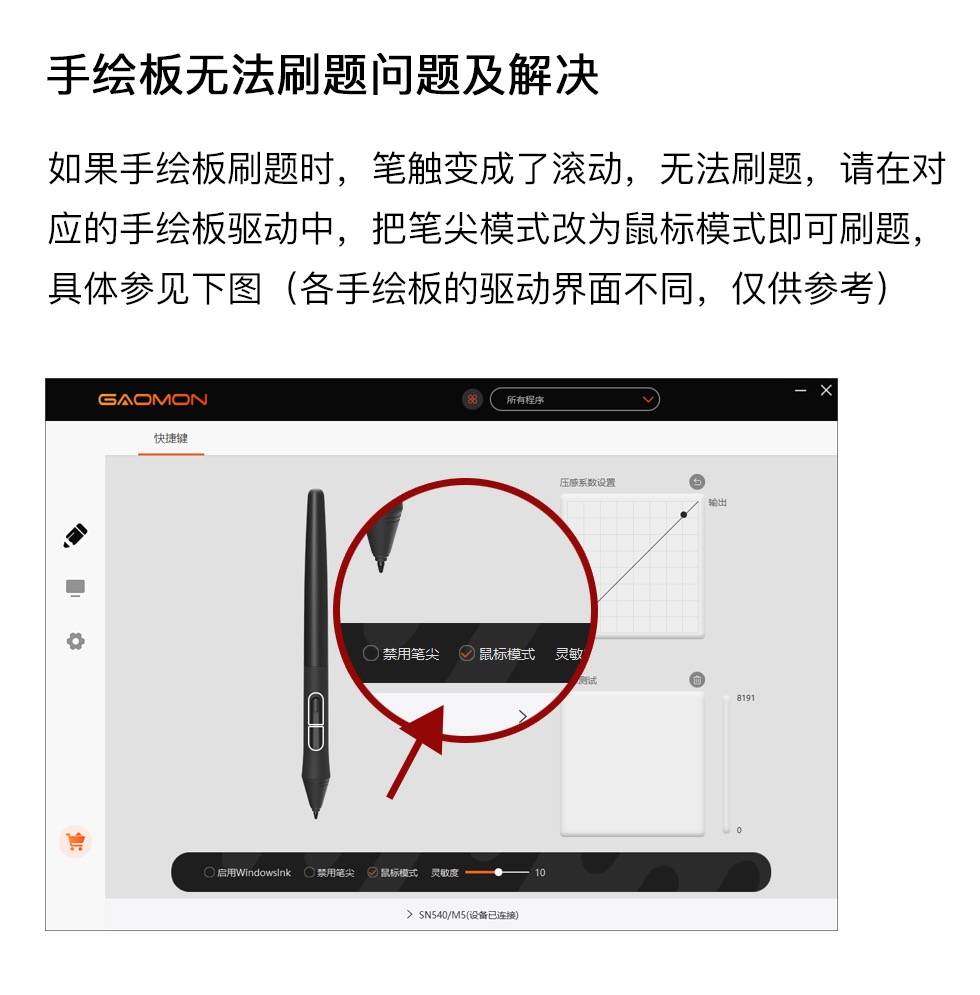
431kJ
已知断开1molH-H键吸收的能量为436kJ,形成1molH一N键放出的能量为391kJ,根据化学方程式N2+3H22NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN=N键需吸收的能量是( )
945.6kJ
649kJ
869kJ

将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了( )
该反应是吸热反应
该反应是放热反应
铁粉和硫粉在常温下可以发生反应
硫化亚铁的总能量高于铁粉和硫粉的总能量

已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A的能量一定高于C
B的能量一定高于D
A和B的总能量一定高于C和D的总能量
该反应为放热反应,故不必加热就一定能发生

如图是化学反应中物质变化和能量变化的示意图。若E1>E2,则下列反应符合该示意图的是( )

NaOH溶液与稀盐酸的反应
锌与稀盐酸的反应
氢氧化钡与氯化铵固体的反应
一氧化碳在空气中的燃烧反应

已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为 436kJ,水蒸气中1molH一O键形成时放出热量463kJ,则O2中1molO=O键完全断裂时吸收热量( )

CH4在O2中燃烧生成CO2和气态H2O的反应是一个放热反应,在反应过程中( )
核能转化成热能
化学能转化成热能
生成物的总能量等于反应物的总能量
生成物的总能量大于反应物的总能量

如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

500mL2.0mol·L-1HCl溶液和500mL2.0mol·L-1NaOH溶液的反应符合图(a),且放出热量为△E1
500mL20mol·L-1H2SO4溶液和500mL2.0mol·L-1Ba(0H)2溶液的反应符合图(b),且吸收热量为△E2
发生图(a)能量变化的任何反应,一定不需要加热即可发生
CaO、浓硫酸分别溶于水时的能量变化均符合图(a)

如图所示,把试管放入盛有25°C饱和石灰水的烧杯中,试管中开始放入粉末状的二氧化锰,再用胶头滴管滴入5mL 10%的过氧化氢溶液于试管中。试回答下列问题:

实验中观察到的现象 。
产生上述现象的原因是 。
写出反应的化学方程式 。
由实验推知,O2和H2O的总能量 (填"大于"“小于”或"等于”)H2O的总能量。