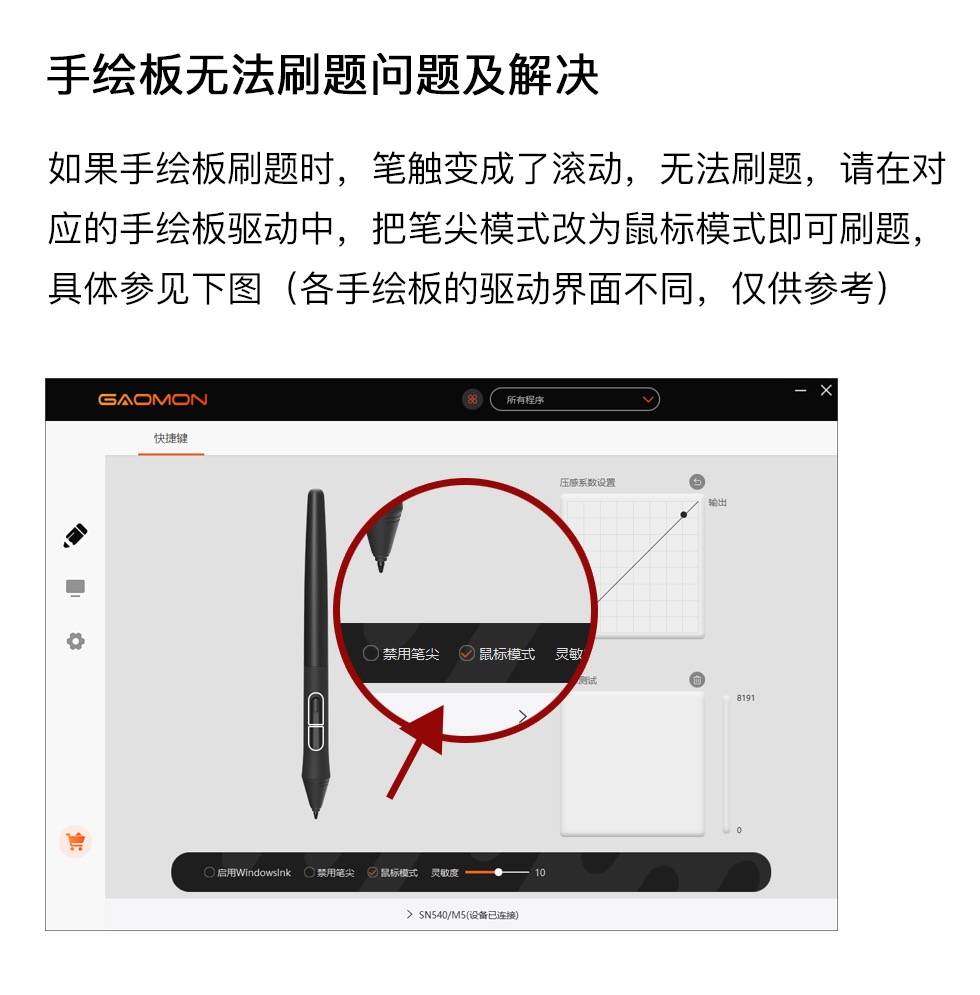
如图所示实验可证明元素的非金属性:CI>C>Si
根据元素周期表和元素周期律,判断下列叙述不正确的是( )

氢元素与其他元素可形成共价化合物或离子化合物
气态氢化物的稳定性:H20>N>SiH4
用中文(ao)命名的第118号元素在周期表中位于第七周期O族

下列关于元素周期表的说法正确的是( )
若原子序数为n的原子在第IIA族,则原子序数为n+1的原子一定在第IIIA族

下列关于有机化合物的说法正确的是( )
聚氯乙烯分子中含碳碳双键
汽油、柴油和植物油都是碳氢化合物

下列关于焰色反应实验的说法不正确的是( )
焰色反应可以检测溶液中的钠离子、钾离子等,属于物理变化
用铂丝蘸取少量某溶液进行颜色反应火焰呈黄色,则该溶液中一定不含K+

Na代表阿伏加德罗常数的值。下列叙述正确的是( )
20g分子中含有的中子数为10
常温下,2.2gCO2中含有共用电子对的数目为
8.7gMnO2与含有0.4molHCl的浓盐酸充分反应,转移的电子数为0.2

我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上.......其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
萃取
渗析
蒸馏
过滤

下列说法正确的是( )
糖类均有甜味,均符合通式
酒精能使蛋白质变性,可用于杀菌消毒
糖类物质均能发生水解反应
油脂、蛋白质均为高分子化合物

化学是开发新材料、新能源,解决环境问题的重要工具。下列说法不正确的是( )
植物秸秆可以生产燃料酒精
高纯度二氧化硅可作半导体芯片
氮氧化物的排放会引起酸雨
使用可降解塑料可减少白色污染

下面所写的有机反应方程式及其类型都正确的是( )
加成反应


 +3H2O 取代反应
+3H2O 取代反应
 加成反应
加成反应

 加聚反应
加聚反应

合成橡胶的单体是( )
=CHCH=
 和
和 =CHCN
=CHCN
 =
= 和
和 =CHCN
=CHCN
 =CHCH=CHCH=CHCN
=CHCH=CHCH=CHCN
 =
= 和
和 =CHCH=CHCN
=CHCH=CHCN


下列实验不能达到预期目的的是( )
探究乙烯与的加成反应

探究苯分子是否含有碳碳双键

探究乙醇的还原性

制取少量乙酸乙酯


下列有关电池的说法不正确的是( )
把铜片插入FeC溶液中,在铜片表面出现一层铁,化学能转化为电能

下列有关说法正确的是( )
一氯甲烷的电子式为

乙醇分子的球棍模型为

苯的结构简式为C6H6
新戊烷中所有的碳原子不可能处于同一平面

下列过程中,有共价键被破坏的是 ①碘晶体升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化 ⑥NH4Cl受热“升华” ⑦NaOH熔化 ⑧NH4HSO4溶于水

某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )

分子式为
可使溴水和酸性高锰酸钾溶液褪色,但褪色原理不同

下列有机物同分异构体数目判断错误的是( )
分子式为C5H12,3个同分异构体
分子式为C5H10,能使溴的四氯化碳溶液褪色,5个同分异构体
分子式为C4H10O,能与Na反应生成氢气,4个同分异构体
分子式为C4H8O2,能与NaHCO3反应,3个同分异构体

苯乙烯是重要的化工原料。下列有关苯乙烯的说法正确的是( )
易溶于水
能使酸性高锰酸钾溶液褪色
与氯化氢反应可以生成氯代苯乙烯
在催化剂存在下可以制得聚苯乙烯

150°C时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150°C,体积恒定时, 容器内压强增大8%,则该混合烃的组成是( )
甲烷与乙烷体积比是1:4
丙炔与乙炔体积比是1:4
乙烯与丁烷体积比是1:4
乙烯与丁烯体积比是1:4

为比较和
对
分解反应的催化效果,甲、乙两位同学分别设计了如图甲、图乙所示的实验。下列叙述中不正确的是( )

图甲所示实验可通过观察产生气泡快慢来比较反应速率的大小
用图乙所示装置测定反应速率,除图示装置外还需要秒表
若图甲实验中反应速率为①>②,则一定说明比
对
分解催化效果好
检查图乙装置的气密性,可关闭A处活塞,将注射器的活塞拉出一定距离,过一段时间后再松开活塞,观察活塞是否回到原位

下列有关物质分离或提纯方法正确的是( )
为除去甲烷中混有的乙烯,将混合气体通入酸性溶液
为分离出蛋白质,向鸡蛋清溶液中加入饱和溶液,过滤

下表是A、B、C、D四种有机物的有关信息:

根据表中信息回答下列问题:
写出与A互为同系物且比A多一个碳原子的有机物在一-定条件 下生成高分子化合物的化学反应方程式_。
B具有的性质是__ (填序号) :
①无色无味液体②有毒③不溶于水④密度比水大⑤与 酸性KMnO4溶液和溴水反应褪色⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_。
C与D反应能生成相对分子质量为100的酯E,该反应类型为_; 其化学反应方程式为:_。
请写出所有满足下列条件的E的同分异构体结构简式:_。

图示的球棍模型是常用的一种抗感冒药的分子模型,已知该分子由C、N、O、H四种元素的原子构成,图中四种不同颜色的小球代表四种原子,两球之间可能是单键、双键、三键。下列关于该物质的叙述正确的是( )

分子式为

将一定量甘油溶于甲苯
 中,混合液中氢元素质量分数为( )
中,混合液中氢元素质量分数为( )
无法计算
8.7%
17.4%
4.35%

近年来甲醇用徐日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2L密闭容器内,400°C时发生反应:,体系中甲醇的物质的量n
随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
n (mol) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
右图中表示的浓度变化的曲线是 __________(填字母)
用表示从0~2s内该反应的平均速率v(
 )=_______________
)=_______________
能说明该反应已达到平衡状态的是__________
容器内CO与的浓度相等
容器内气体的密度保持不变
容器内气体的压强不变
已知在400°C时,反应![]() 生成1molCH3OH(g),放出的热量为116kJ。计算上述反应达到平衡时放出的热量Q=__________ kJ。
生成1molCH3OH(g),放出的热量为116kJ。计算上述反应达到平衡时放出的热量Q=__________ kJ。

短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这此元套组成的化合物、d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体、上述物质的转化关系如下图所示。下列说法正确的是( )

原子半径:Y>Z
简单气态氢化物的热稳定性:X>Y
W与X可形成多种含有非极性键的共价化合物
a一定由W、X两种元素组成

A是一种重要的化工原料,是石油裂解气的主要成分,A的产量常用来衡量一个国家的石油化工水平。D的分子式为,有强烈的刺激性气味。E是具有果香气味的液体.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

请回答下列问题:
工业上,由石油获得石蜡油的方法是______________
写出与A互为同系物且比A多一个碳原子的有机物在一定条件下生成高分子化合物的化学反应方程式_________________________
反应B→C的化学方程式为___________________
实验室利用B与D反应制取E,其装置如图所示:
①反应B+D→E的化学方程式为____________________
②能完成本实验的装置是_____________________,从试管B中分离出E的操作名称为________________。

分别处于元素周期表第2、3周期的主族元素A和B,它们离子的核外电子层相差两层。已知A处于第m族,B处于第n族,且A只有正化合价。则A、B两元素的原子序数分别为( )
m、n
m-2、10-n
m+2、n+10
m+8、n+10

现有五种短周期的主族元素A、B、C、D、E。已知:①A与B同周期。在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;②A与B的质子数之和是D质子数的3倍;③、
具有相同的电子层结构;④热稳定性:
。依据上述信息用相应的化学用语回答下列问题:
C在元素周期表中的位置为_______________。
的电子式_______________, 五种元素原子形成的简单离子的半径由大到小的顺序为____________________ (用离子符号表示)。
将B的单质跟A与D形成的化合物的水溶液在常温下反应的离子方程式为:____________________
能证明与
还原性强弱的化学方程式为____________________。