已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)  Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )



①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3

CO(g)+  O2(g)= CO2(g) ΔH=−283.0 kJ·mol−1②
O2(g)= CO2(g) ΔH=−283.0 kJ·mol−1②
C(石墨)+O2(g)= CO2(g) ΔH=−393.5 kJ·mol−1③
则4Fe(s)+3O2(g)= 2Fe2O3(s)的ΔH为( )

4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是( )

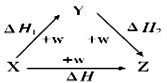
4Al(s)+3O2(g)=2Al2O3(s) ΔH1
4Al(s)+2O3(g)=2Al2O3(s) ΔH2
3O2(g)=2O3(g) ΔH3则( )

30 g二甲基肼完全燃烧放出的热量为( )


H2O(g)=H2(g)+  O2(g) ΔH=+241.8 kJ/mol
O2(g) ΔH=+241.8 kJ/mol
H2(g)+  O2(g)=H2O(l) ΔH=-285.8 kJ/mol,当1 g液态水变为水蒸气时,其热量变化是( )
O2(g)=H2O(l) ΔH=-285.8 kJ/mol,当1 g液态水变为水蒸气时,其热量变化是( )

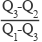
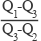
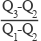
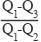


C(金刚石,s)+O2(g)=CO2(g) ΔH1
C(石墨,s)+O2(g)=CO2(g) ΔH2
C(石墨,s)=C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )



CO2(g)+C(s)=2CO(g) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )

①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )

 O2(g)=ZnO(s) ΔH=-348.3 kJ·mol-1 (2)2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3 kJ·mol-1 (2)2Ag(s)+  O2(g)=Ag2O(s) ΔH=-31.0 kJ·mol-1
O2(g)=Ag2O(s) ΔH=-31.0 kJ·mol-1则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的ΔH等于( )

①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+  O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )

 O2(g) =CO (g ) ΔH1 C(s) +O2(g) =CO2 (g ) ΔH2
O2(g) =CO (g ) ΔH1 C(s) +O2(g) =CO2 (g ) ΔH2 H2(g) +
H2(g) +  Cl2(g) =HCl(g) ΔH2
Cl2(g) =HCl(g) ΔH2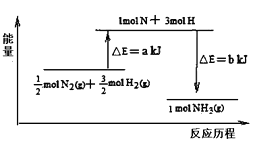
又已知:①已知b=1173;②25℃、101 kPa下N2(g)+3H2 (g) =2 NH3 (g) ΔH =-92 kJ·mol−1,则a =_________。

S(g)+O2(g)=SO2(g) ΔH2
ΔH1_________ΔH2
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
ΔH1_________ΔH2
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2
ΔH1_________ΔH2

N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
气态肼和二氧化氮反应的热化学方程式为_________。

试回答下列问题:
已知:
P4(白磷,s)+5O2(g)= P4O10(s) ΔH=−2983.2 kJ·mol−1 ①
P(红磷,s)+  O2(g)=
O2(g)=  P4O10(s) △H=−738.5 kJ·mol−1 ②
P4O10(s) △H=−738.5 kJ·mol−1 ②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。

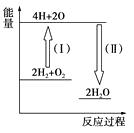
 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。 已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)_________(填“吸收”或“放出”)_________kJ。