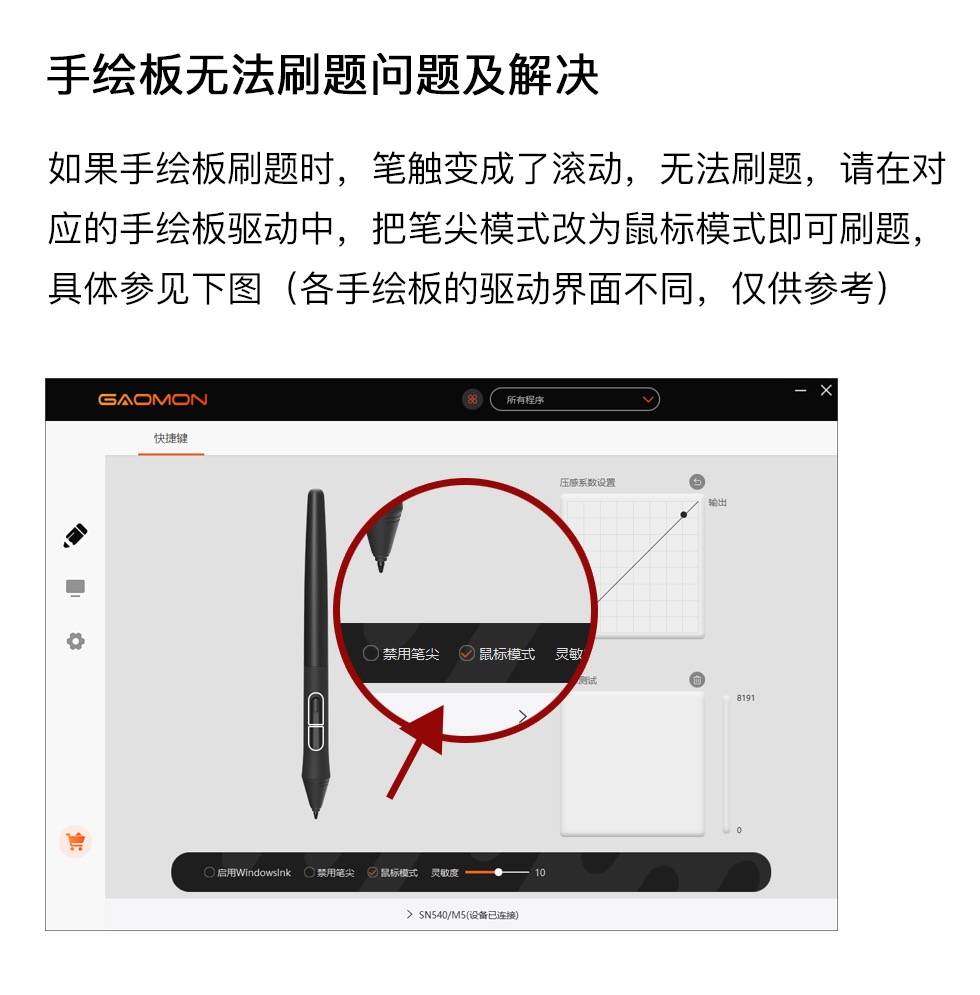
下列有关σ键的说法中,错误的是( )
如果电子云图像是由两个s电子重叠形成的,即形成了s-sσ键






①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2




氢气分子的形成过程示意图
H—H键的键长为_________,①~⑤中,体系能量由高到低的顺序是_________。
下列说法中正确的是 ( )
已知几种常见化学键的键能为
化学键 | Si—O | H—O | O | Si—Si | Si—C |
460 | 467 | 498 | 176 | X |
请回答下列问题:
①比较Si—Si键与Si—C键的键能大小可知X_________(填“>”“ <”或“=”)176kJ·mol-1。
②H2被喻为21世纪人类最理想的燃料,而更有科学家提出硅是“21世纪的能源”“未来的石油”的观点。试计算:每千克H2燃烧(生成水蒸气)放出的热量约为_________;每摩尔硅完全燃烧放出的热量约为_________。

A、NH3 B、H2O C、HCl D、CH4 E、C2H6 F、N2
①所有的价电子都参与形成共价键的是________;
②只有一个价电子参与形成共价键的是________;
③最外层有未参与成键的电子对的是________;
④既有σ键又有π键的是________。

现有原子序数小于20的A、B、C、D、E、F6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题:
用电子式表示C和E形成化合物的过程_________。
写出基态F原子的核外电子排布式_________。
写出A2D的电子式_________,其分子中_________(填“含”或“不含”,下同)σ键,_________π键。
A、B、C共同形成的化合物中化学键的类型有_________。

键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
键能 | 436.0 | 193.7 | 152.7 | 242.7 | 431.8 | 298.7 | 366 |
共价键中H—H键的键能比Cl—Cl键的键能大,其原因是_________。
1molH2在2molCl2中燃烧,放出热量_________kJ。
预测1molH2在足量F2中燃烧比在Cl2中燃烧放热_________(填“多”或“少”)。
在一定条件下,1molH2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是_________ 。

SiO32-、SO3、NO3-三种粒子_________(填“是”或“不是”)等电子体,其中Si、S、N三种基态原子的第一电离能的大小关系为_________。
C2O42-和_________是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素周期表中的位置是_________,外围电子排布式为_________。
两原子14个电子的等电子体的共同特点是物质中都具有共价三键,请举出相应的3个例子:_________(分子或离子)。每个分子或离子中含_________个σ键,_________个π键。

 O
O