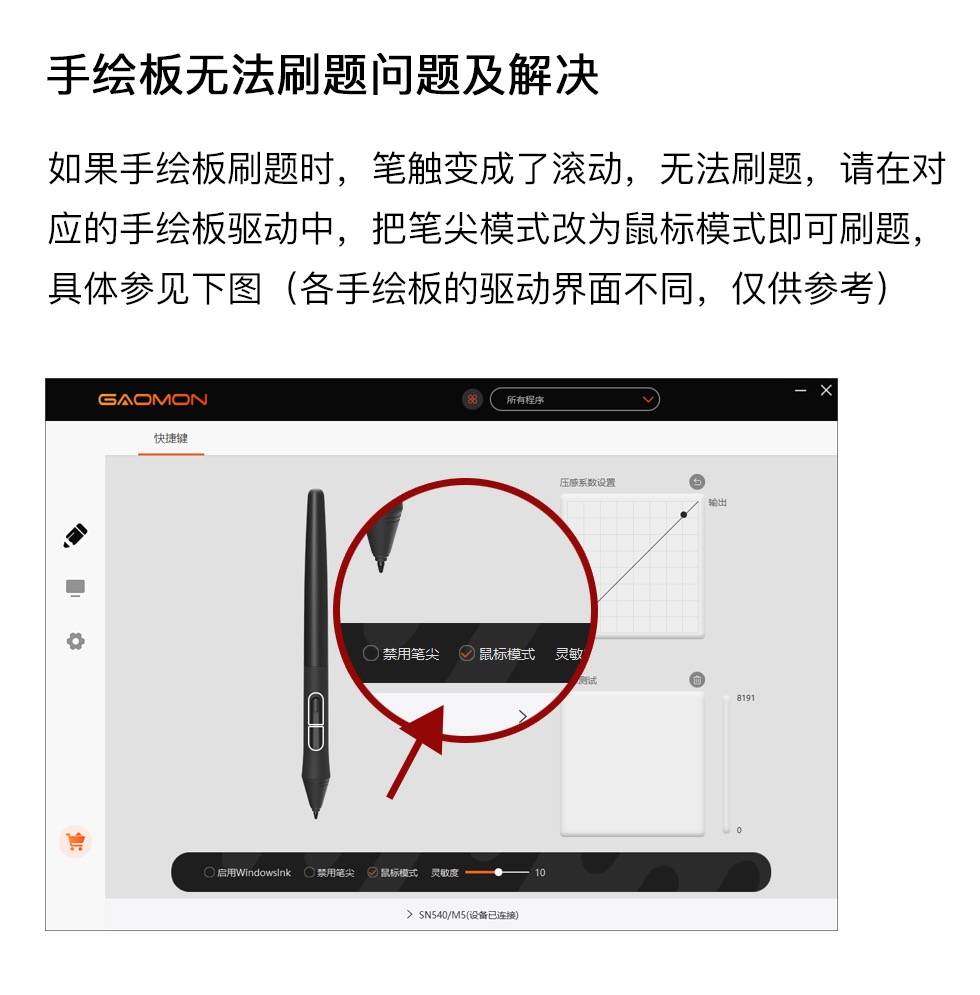
I2+SO2+2H2O===H2SO4+2HI
2FeCl2+Cl2===2FeCl3
2FeCl3+2HI===2FeCl2+2HCl+I2

①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应


 和F2可发生如下反应:RO
和F2可发生如下反应:RO +F2+2OH-===RO
+F2+2OH-===RO +2F-+H2O,从而可知在RO
+2F-+H2O,从而可知在RO 中,元素R的化合价是( )
中,元素R的化合价是( )










用下列方法均可制得氧气:
①\( 2 \mathrm{KClO}_{3} \stackrel{M n \mathrm{O}_{2}}{\triangle} 2 \mathrm{KCl}+3 \mathrm{O}_{2} \)↑
②2HgO 2Hg+O2↑
2Hg+O2↑
③2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )


CaCO3CaO+CO2↑









下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)  2H2O+2Cl2
2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )



试剂 | 操作 |
①H2SO4溶液 | a.把样品放入H2SO4溶液中,再加入淀粉溶液 |
②KMnO4溶液 | b.把样品放入H2SO4溶液中,溶解后再加入所选试剂 |
③KI溶液 | c.把样品放入水中,溶解后再加入所选试剂 |
④AgNO3溶液 | d.把样品放入盐酸中再加入所选试剂 |
⑤淀粉溶液 |
方案一:试剂及操作: , 现象:。
方案二:试剂及操作: , 现象:。

a.2F2+2H2O===4HF+O2
b.2Na+2H2O===2NaOH+H2↑
c.CaO+H2O===Ca(OH)2
d.2H2O2H2↑+O2↑
水只作氧化剂的是_________(填字母序号,下同),水只作还原剂的是_________,水既作氧化剂又作还原剂的是_________,水既不作氧化剂又不作还原剂的是_________。
用双线桥法表示D反应中电子转移情况。
_________。

请回答下列问题:
+=+
。该反应中是氧化剂。


 Al2O3+2Fe所属基本反应类型是________。在该反应中________元素的化合价升高,该元素的原子________电子,被________;而________元素的化合价降低,该元素的原子________电子,被________。该反应中,Fe2O3发生了________反应,Al发生了________反应,________是氧化剂,________是还原剂,________是氧化产物,________是还原产物。
Al2O3+2Fe所属基本反应类型是________。在该反应中________元素的化合价升高,该元素的原子________电子,被________;而________元素的化合价降低,该元素的原子________电子,被________。该反应中,Fe2O3发生了________反应,Al发生了________反应,________是氧化剂,________是还原剂,________是氧化产物,________是还原产物。
反应①中生成1 mol O2转移电子的物质的量为________,反应①、②的总反应方程式为________,
在该反应中Fe3+的作用为________。